MEDELIA – la prima software suite modulare per gestione Post Market ed eIFU di dispositivi medici dedicata alla conformità MDR
MEDELIA evolve il nostro primo modulo software dedicato alle eIFU ed alla digitalizzazione delle istruzioni d’uso elettroniche. Nasce ascoltando le esigenze dei nostri clienti e diventa una vera e propria “medical suite” con l’obiettivo di soddisfare le diverse esigenze delle aziende produttrici dettate da contesti normativi in continua evoluzione.
Siamo soci inoltre BioPmed, il principale polo di innovazione dedicato alla Salute e alle Scienze della Vita della Regione Piemonte.
Scopri la suite MEDELIA ed i suoi moduli!
Scarica la brochure Richiedi una demo
Una soluzione modulare che cresce con l’azienda
La sua concezione “a moduli” ti permette di avere una soluzione che rispecchia le tue esigenze di oggi ma che potrà crescere con te per soddisfare le nuove esigenze e sfide di domani.
Al momento, la suite è dedicata alle necessità delle aziende che producono dispositivi medici ed in vitro ma è sempre in continua espansione.
Scopri i vantaggi di passare ad un software
Una suite completa per la conformità MDR
La nostra visione va oltre la semplice digitalizzazione di processi isolati. Crediamo in un approccio olistico alla conformità MDR, dove diversi moduli software comunicano tra loro creando sinergie potenti. È in quest’ottica che stiamo evolvendo Medelia per integrare la gestione delle istruzioni per l’uso elettroniche (eIFU) con il sistema PMS e PMCF.
riduzione costi
Fino al 70% del tempo in meno!
I nostri clienti riportano una riduzione significativa del tempo dedicato alla gestione dei dati post-market, con risparmi che possono raggiungere il 70% per alcune attività critiche come la compilazione dei report PSUR.
tracciabilità completa
Stop a documenti sparsi!
Medelia registra automaticamente ogni azione effettuata nel sistema, creando un audit trail dettagliato che semplifica enormemente le ispezioni regolatorie e le verifiche di conformità.
Efficienza e Scalabilità
Medelia è “API first”!
L’integrazione con altri sistemi aziendali è semplice. Ci interfacciamo con i sistemi di gestione della qualità, CRM e ERP. Creando un ecosistema digitale che elimina la duplicazione di dati e sforzi.
MEDELIA è pensata per le aziende produttrici ma intendiamo supportare tutti gli stakeholder del mercato quali “regulatory affairs” e “società di consulenza”. Se rappresenti una di queste realtà scrivici per maggiori informazioni.
Novità MDR gennaio 2025
Resta aggiornato e conforme al regolamento MDR
La recente proposta della Commissione Europea di estendere l’ambito di applicazione delle eIFU a tutti i dispositivi medici destinati a professionisti sanitari rende questo approccio integrato ancora più rilevante. Le aziende che adottano ora soluzioni digitali complete come MEDELIA si troveranno in una posizione vantaggiosa quando queste modifiche normative entreranno in vigore.
Affrontare la transizione digitale e l’adeguamento alle nuove normative con un unico partner tecnologico.
Scopri i moduli di medelia
Resta aggiornato e conforme al regolamento MDR
Questa integrazione crea un ciclo virtuoso: i dati raccolti attraverso il sistema PMS identificano la necessità di aggiornare le istruzioni per l’uso, l’aggiornamento avviene rapidamente grazie al modulo eIFU, e il feedback sul nuovo contenuto viene nuovamente raccolto dal sistema PMS, permettendo un miglioramento continuo basato su dati reali.
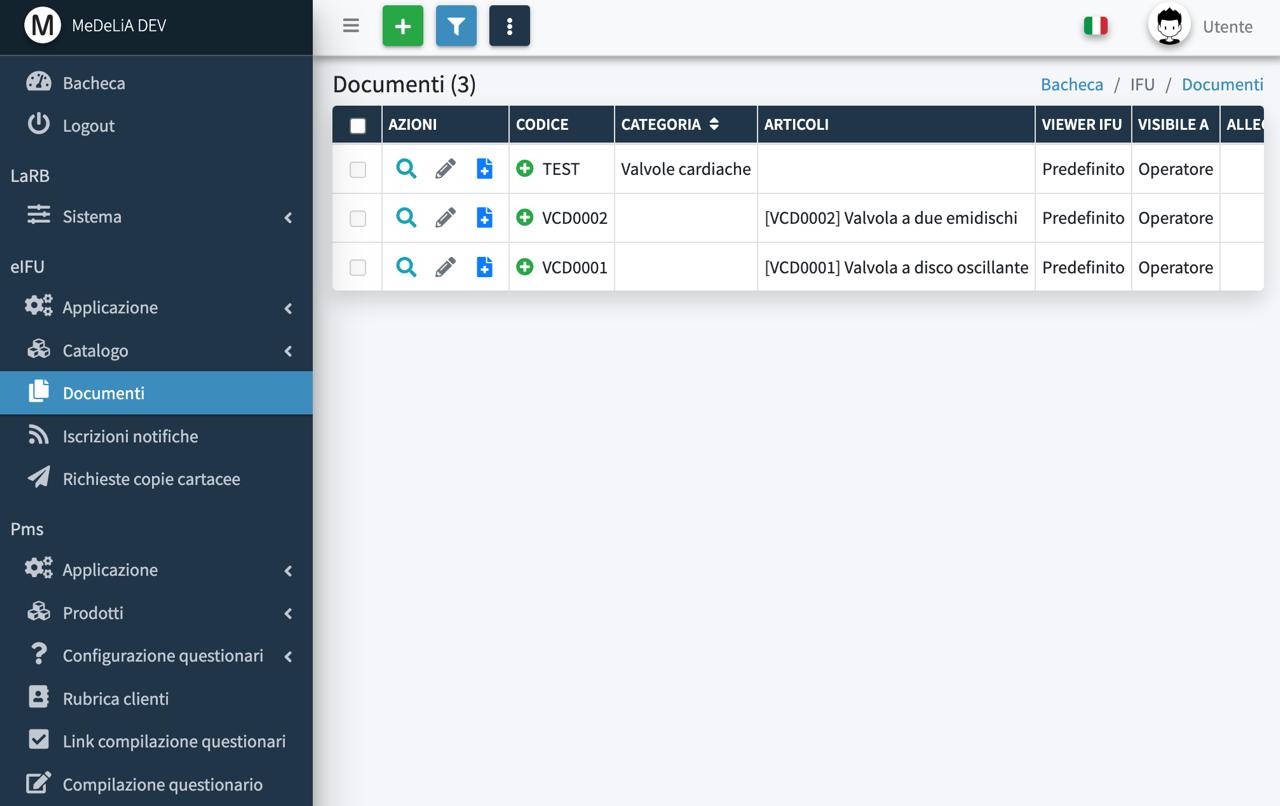
Modulo eIFU
Pubblicazione immediata revisioni
Notifica instantanea revisioni
Gestione documentazione multi-lingua, articoli e lotti
QR Code scan-and-view e scan-and-download
Ricerca semplice e avanzata sul portale web
Grafica personalizzabile e possibilità di scelta del target sul portale web
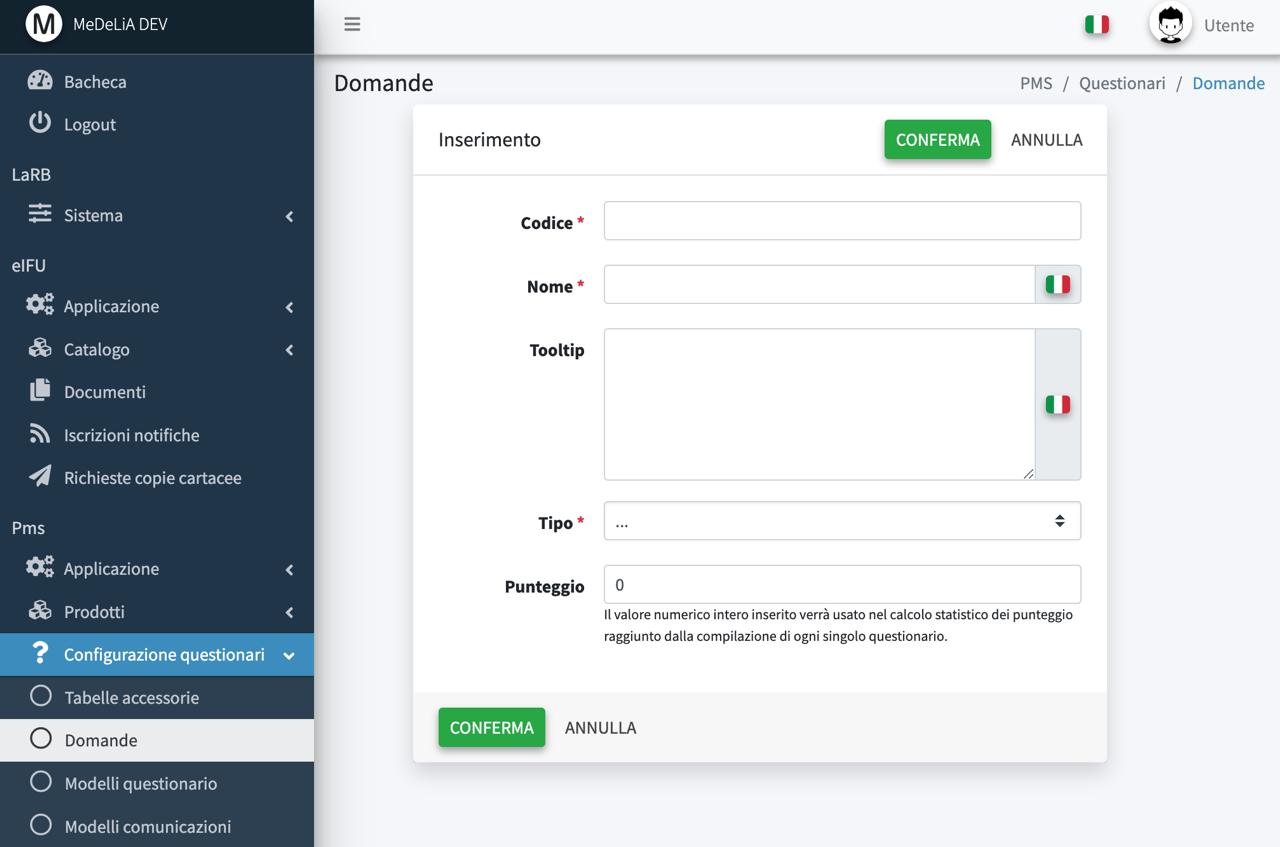
Modulo PMS / PMCF
Dashboard di monitoraggio
Questionari personalizzati e moduli di raccolta dei dati clinici
Livelli di soglia / score, gestione notifiche, follow-up e allarmi (configurabili)
Statische e grafici
Configurazione dedicata per clienti diretti ed indiretti
Realizzazione report EUDAMED (in sviluppo)
NOVITÀ
Stiamo sviluppando QRA!
Il nuovo modulo permetterà di gestire la documentazione tecnica necessaria per l’immissione dei dispositivi medici sul mercato.
Questa integrazione semplificherà ulteriormente la gestione degli adempimenti normativi e rappresenta un ulteriore passo verso l’obiettivo di MEDELIA offrire una suite completa dedicata ai produttori di dispositivi medici.
Affidati ad un partner affidabile!
Affidati ad un partner tecnologico riconosciuto nel settore.
Disponibile in versione cloud & On-premise

MEDELIA in “cloud” è ospitata sui nostri server conformi alle normative e con sistemi in alta affidabilità, ridondati e backup costanti.

MEDELIA in “OnPremise” è ospitata invece sui tuoi server aziendali e ti consigliamo di scarica la brochure per approfondire i requisiti hardware.
Blog
Leggi i nostri ultimi articoli
medelia è certification ready
Un contesto normativo in continua evoluzione
Ogni modulo di MEDELIA è conforme ai regolamenti europei, ti forniamo ogni modulo software corredato dai documenti di validazione previsti dalle normative vigenti (FDA e MDR). Il software è quindi pronto per superare la tua certificazione.
In questa sezione troverai i regolamenti e le linee guida di riferimento.
Regolamenti e Linee Guida
Regolamento (UE) 2017/745 del 5 aprile 2017 relativo ai dispositivi medici stabilisce i requisiti per la sorveglianza post-marketing e il follow-up clinico post-market per garantire la sicurezza e la performance continua dei dispositivi medici. Include disposizioni dettagliate sui piani di PMS e PMCF.
• Articolo 83-86: Specificano gli obblighi dei produttori per quanto riguarda la PMS.
• Allegato XIV, Parte B: Dettaglia i requisiti per il PMCF.
Analogamente all’MDR, l’IVDR richiede che i produttori di dispositivi diagnostici in vitro implementino piani di sorveglianza post-marketing e follow-up clinico post-market.
• Articolo 78-81: Specificano gli obblighi dei produttori per quanto riguarda la PMS.
• Allegato XIII, Parte B: Dettaglia i requisiti per il PMCF.
Smart software for your business!
Non esitare a contattarci, saremo al tuo fianco in ogni passaggio implementativo e potrai usufruire delle nostra assistenza. Scopri di più sulla piattaforma scaricando la brochure oppure richiedi il video di una demo dimostrativa!



