eIFU – il nostro modulo per la gestione delle istruzioni d’uso (IFU) in formato digitale
Semplifica e velocizza la gestione delle istruzioni per l’uso dei tuoi dispositivi medici (MD) e diagnostici in vitro (IVD) adottando il nostro modulo software.
Affidati ad un partner esperto: dal 2021 RealBit è socio BioPmed, il principale polo di aggregazione delle imprese per la ricerca e l’innovazione nel settore medicale sul territorio della regione Piemonte.
Scopri i vantaggi che eIFU può portare nella tua realtà aziendale!
Scarica la brochure Richiedi una demo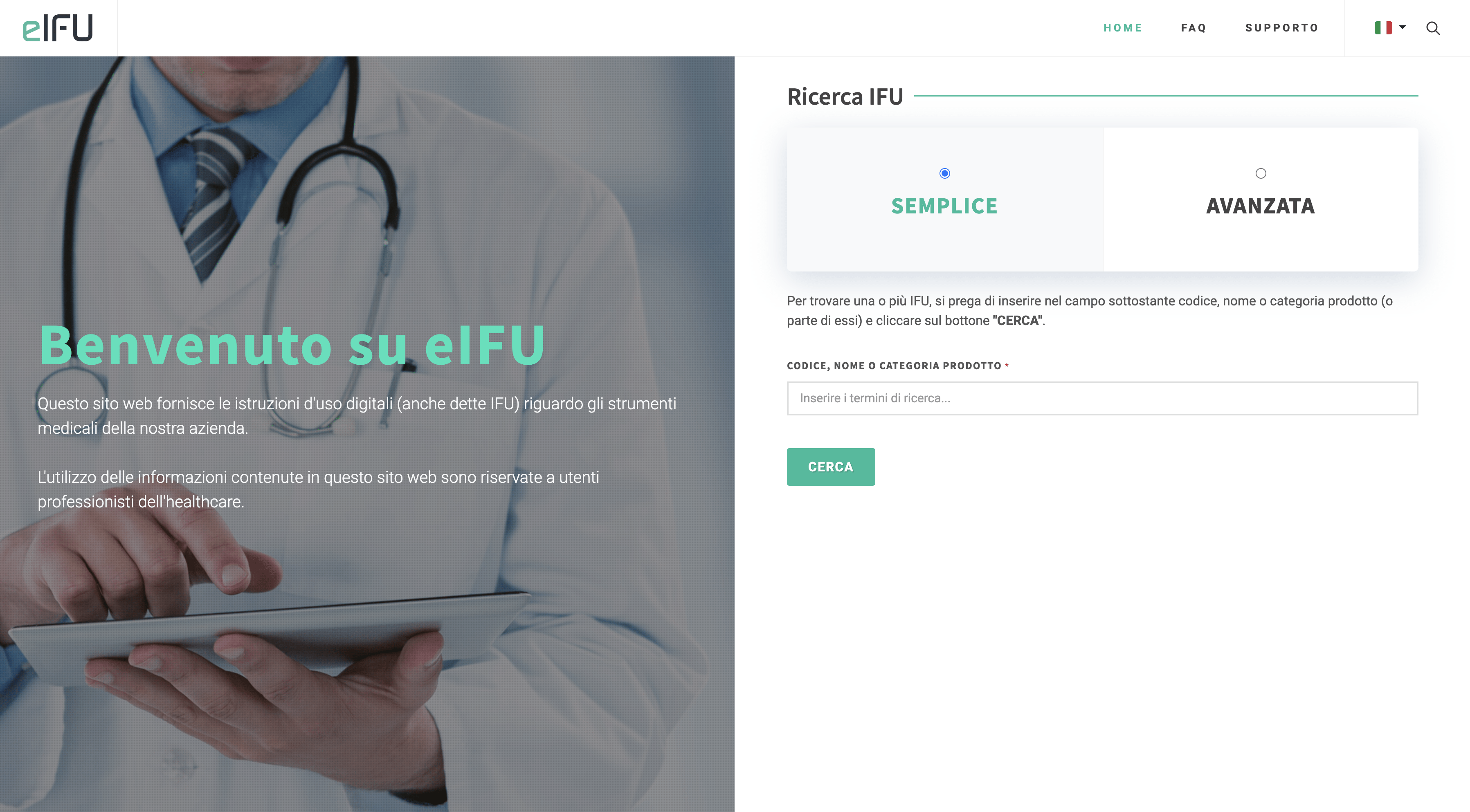
Una soluzione semplificata per le tue istruzioni d’uso
Lavoriamo da anni in progetti di digitalizzazione d’impresa, e dal 2021 abbiamo deciso di portare la digitalizzazione anche nel settore medicale con eIFU, la nostra soluzione software per la gestione delle IFU elettroniche.
Bastano pochi click e le nuove revisioni delle tue IFU saranno online a disposizione dei tuoi clienti, nel rispetto delle normative vigenti.
I vantaggi di passare alle eifu
Risparmio, ottimizzazione e sostenibilità
Nel passaggio dal cartaceo al digitale e adottando la nostra soluzione otterrai vantaggi tangibili e concreti in termini di risparmio di costi, tempo e ottimizzazioni logistiche e darai un concreto contributo alla sostenibilità ambientale.
Abbatti i costi materiali
Con i QR Code generato da eIFU riduci le dimensioni, i costi dei packaging ed aumenta il risparmio economico.
Gestione semplificata
Gestisci le tue IFU all’interno di un unico portale online, accessibile ovunque da ogni dispositivo.
Software conforme e certification-ready
eIFU è conforme alle normative, insieme al software forniamo i documenti di validazione necessari le certificazioni.
affidati ad un partner specializzato
NOVITÀ 2025: stiamo sviluppando MeDeLiA!
A partire da gennaio 2025 la sorveglianza post-marketing (PMS) e il follow-up clinico post-market (PMCF) diventeranno strumenti indispensabili per permettere alle aziende produttrici di dispositivi medici di mantenere la conformità durante la certificazione. eIFU, la nostra soluzione dedicata alla gestione delle istruzioni d’uso elettroniche, cresce e diventa parte di una vera e propria medical suite che ha l’obbiettivo di soddisfare le diverse esigenze delle aziende produttrici di dispositivi medici e diagnostici in vitro.
Scopri i vantaggi di affrontare la transizione digitale e l’adeguamento alle nuove normative con un unico partner tecnologico.
RealBit è socio BioPmed dal 2021 per l’innovazione nel settore medicale.
Key Features
Scopri i principali punti di forza del nostro software
Ecco le principali funzioni che i nostri clienti apprezzano:
Pubblicazione immediata revisioni
Notifica instantanea revisioni
Gestione documentazione multi-lingua, articoli e lotti
QR Code scan-and-view e scan-and-download
Ricerca semplice e avanzata sul portale web
Possibilità di scelta del target sul portale web
Grafica personalizzabile
Il Software è “certification-ready” ovvero fornito dei documenti di validazione e conforme alle normative: FDA e MDR!

Disponibile in cloud o on-premise

Scegli eIFU in cloud, hostato su server RealBit conformi alle normative in ambito medicale. Studiato per garantire una elevata affidabilità e con backup costanti.

Installa eIFU sui tuoi server aziendali, scarica la brochure per approfondire i requisiti hardware.
REALBIT TIPS
Alcuni consigli per passare alle eIFU
Considerazioni normative
Determina se le IFU elettroniche sono accettate per il tipo di prodotti che produci e nei paesi in cui vendi i tuoi prodotti. eIFU permette comunque ai tuoi clienti di richiedere la copia cartacea se necessario, come indicato dalle normative. La nostra soluzione eIFU è conforme al regolamento (UE) 2017/745 ed il software viene fornito con adeguata validazione. Dal momento in cui scegli eIFU, il software è pronto all’uso e con i documenti di validazione che RealBit ti fornirà a corredo, potrai intraprendere serenamente il percorso di certificazione.
Valuta la tua soluzione hardware
Verifica se i tuoi server sono conformi alle normative scaricando la brochure, oppure scegli la soluzione in cloud. RealBit si occuperà di fornire un server configurato secondo i parametri richiesti per il settore medicale.
Gestisci le traduzioni e personalizza la grafica
Con eIFU puoi fornire ai tuoi clienti le IFU direttamente nella propria lingua, oppure fornire un unico file multilingua. Personalizza la grafica del portale dedicato ai clienti con l’utilizzo di colori, immagini e video per mantenere la tua brand identity.
Il futuro delle IFU
Un contesto normativo in evoluzione
La digitalizzazione delle IFU sta emergendo sempre più nel settore dei dispositivi medici (MD) e diagnostici in vitro (IVD) in Europa ed in tutto il mondo. Il loro monitoraggio è al centro delle attività delle autorità regolatorie per garantire benefici a tutta la filiera, dai produttori agli utenti finali, e migliorare la qualità e la sostenibilità rispetto alle versioni cartacee.
RealBit può aiutare in questo aspetto, fornendo un software già validato secondo le principali normative vigenti (FDA e MDR) e pronto alla certificazione.
In questa sezione troverai i regolamenti e le linee guida di riferimento a cui eIFU si attiene.
Regolamento (UE) 2017/745 del 5 aprile 2017 relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive del Consiglio 90/385/CEE e 93/42/CEE.
Regolamento (UE) 2017/746 del 5 aprile 2017 relativo ai dispositivi medico-diagnostici in vitro e che abroga la direttiva 98/79/CE e la decisione della Commissione 2010/227/UE.
MEDDEV 2.14/3 rev.1 Fornitura di istruzioni per l’uso (IFU) e altre informazioni per i dispositivi medici diagnostici in vitro (IVD).
Regolamento di esecuzione (UE) 2021/2226 della Commissione del 14 dicembre 2021 che stabilisce le norme per l’applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda le istruzioni per l’uso elettroniche dei dispositivi medici.
Blog
Leggi i nostri ultimi articoli
Smart software for your business!
Non esitare a contattarci, saremo al tuo fianco in ogni passaggio implementativo e potrai usufruire delle nostra assistenza. Scopri di più sulla piattaforma scaricando la brochure oppure richiedi il video di una demo dimostrativa!






